原子の構造
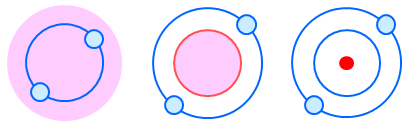
原子の構造として、J.J.トムソンは正電荷の内部を電子が周回しているという模型を考えた(左)。長岡半太郎は正電荷の周囲を電子が回っているという土星型の模型を考えた(中)。その後、ラザフォードはごく小さな領域に正電荷が集まっており、その周囲を電子が回っているという模型を考えた(右)。中心部の正電荷が集まって存在している部分を原子核という。
水素原子のスペクトル
バルマーは水素の可視光線の領域の線スペクトルを調べ、波長λに次のような規則性があることを発見した。

逆数を取って、まとめておく。
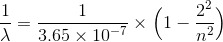
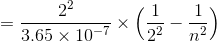
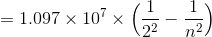
その後、ライマンとパッシェンによって、紫外線と赤外線の領域においても水素原子のスペクトルが発見された。これらの関係をまとめると次のようになる。

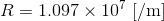
Rをリュードベリ定数という。
- n'=1のスペクトル……ライマン系列
- n'=2のスペクトル……バルマー系列
- n'=3のスペクトル……パッシェン系列
ボーアの原子模型
ラザフォードの原子模型のように電子が原子核の周囲を円運動しているとすれば、電子は加速度を持って運動しているため、電磁波を発生してエネルギーを失って原子核に落ち込んでしまう。ところがそのようなことは起こらない。この問題を解決するため、ボーアは1913年、次のような仮説を立てた。
- 角運動量はh(bar)の整数倍の値しか取ることができない。

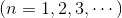
この式はこのように解釈できる。まず、h(bar)をh/2πに戻し、
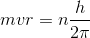
左辺を2πrとすると、

となる。右辺のh/mvはドブロイ波長だから、

と表すことができる。左辺は半径rの円周の長さを表している。つまり、円周の長さがちょうど波長の整数倍であるとき、電子は安定に存在することができるということだ。このとき、電子は定常状態にあるという。この仮説をボーアの量子条件という。
定常状態にある電子のエネルギーをエネルギー準位という。ここでボーアの2つ目の仮説を紹介しよう。
- 定常状態にある電子が他の定常状態へと移るとき、その差にあたるエネルギーhνを電子は吸収、または放出する。
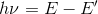
これをボーアの振動数条件という。これにより、ボーアは水素原子のスペクトルを説明することに成功した。
エネルギー準位
それでは、水素原子のエネルギー準位を求めてみよう。水素の原子核は電気量+eである。この原子核から、質量m,電気量-eの電子が半径rで回っているとすると、
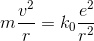
という運動方程式が成り立つ。ここでボーアの量子条件からvが

と表せるので、これを用いてvを消去すると、

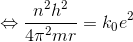
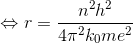
となる。これは水素原子の半径である。n=1のときが安定な水素原子の半径で、ボーア半径という。

ここで、電子の持つエネルギーEは、運動エネルギーKと位置エネルギーUの和になるので、
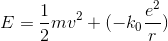
である。ここでボーアの量子条件より、
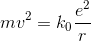
だから、

となる。この式へ、直前に求めたrを代入することで、


エネルギー準位Enを求めることができる。n=1のときがエネルギー最低で、この状態を水素原子の基底状態という。また、それよりもエネルギーの大きなn=2,3,…の状態を励起状態という。
ところで、この結果を用いると、振動数条件の式は

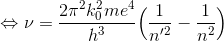
と書き変えられる。ここで、波の基本式「c=νλ」を用いれば
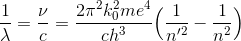
となる。このとき、

はリュードベリ定数と一致している。これにより、

と変形することができる。これはスペクトルのときに登場した式である。つまり、ボーアの仮説から、スペクトルの式を理論的に導出することができたというわけだ。
さらに、Rを使ってEnの式を書き変えると、
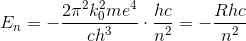
となる。この結果より、n=1のときのEnがE1=-13.6〔eV〕となる。よって、水素原子から電子を取り去って一価の陽イオンにするために必要なエネルギー(電離エネルギー)が13.6eVであることが分かる。
