熱と温度

熱とは何か。物質なのか運動なのか。この問題は、19世紀の半ばまで人類を悩ませた。現在では、熱はエネルギーの1つの形態ということで決着が付いている。高校物理『熱』編の第1回目は、温度変化という部分から熱の性質を見ていこう。
温度

「今日の気温は20℃」「37℃…風邪ひいたかな」のように、普段使っている温度のことをセルシウス温度という。セルシウス温度は1気圧のもとで氷が水になる温度(融点)を0℃、水が水蒸気になる温度(沸点)を100℃と定めて、その間隔を100等分したもの。
あらゆる物質は原子や分子などの小さな粒子が集まって出来ていて、これらは温度が高ければ高いほど活発に動くようになる。これを熱運動という。
逆に、温度を下げていくと熱運動は鈍くなっていき、-273℃に達したとき、ついに熱運動は停止する。この温度を絶対零度と呼び、絶対零度を基準としてセルシウス温度と同じ間隔で目盛りを付けた温度を絶対温度という。絶対温度の単位にはケルビン〔K〕を使う。

熱容量と比熱

熱を加えると温度が上がる。このとき加えた熱の量のことを熱量といい、Q〔J〕と表す。加えた熱量が多ければ多いほど、物体の温度変化も大きいだろうということで、熱量Q〔J〕を温度変化ΔT〔K〕に比例すると考えて、

と表すことにしよう。このときのC〔J/K〕を熱容量という。熱容量は単位からも分かるように「物体の温度を1K上昇させるのに必要な熱量」という意味で、熱容量が大きな物体を温めるためには、熱容量の小さな物体よりもたくさんの熱量が必要なので、熱容量が大きな物体ほど温度が上がりにくい。だから、熱容量は簡単にいうと「物体の温まりにくさ」のことなのだ。
では、熱容量の違いは何で決まるのだろう。例えば、同じ水を温めようとしても、ビーカーの水とお風呂の水だとずいぶん温まりにくさが違う。これは同じ物質のとき、量が多いほど温まりにくいということだ。そこで、熱容量C〔J/K〕はその物質の質量m〔g〕に比例すると考えて、

と表すことにしよう。このときのc〔J/(g・K)〕を比熱という。比熱は物質ごとに異なっていて、単位からも分かるように「物質1gの温度を1K上昇させるために必要な熱量」のことで、熱容量と同じように比熱が大きい物質ほど温度が上がりにくい。
|
物質 |
水 |
Al |
Fe |
Cu |
| 比熱c〔J/(g・K)〕 | 4.2 |
0.90 |
0.45 |
0.38 |
代表的な物質の比熱を比べてみると、圧倒的に水の比熱は大きいことが分かる。つまり、水は非常に温まりにくい物質であるということ。また、温まりにくい物質は冷めにくい物質でもあるということも知っておこう。
さて、比熱c〔J/(g・K)〕を使って熱容量C〔J/K〕を表すことにすると、比熱c〔J/(g・K)〕を使って熱量Q〔J〕を表すこともできる。
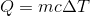
熱量の計算に非常によく使う式なので、必ず覚えておこう。これを熱量の公式と呼ぶことにする。
熱量の保存
熱とは何か?と聞かれたら、「高温物体から低温物体へ移動するエネルギー」だと答えようと思う。この回答の中に熱の大切な性質が詰まっている。

また、高温物体と低温物体を接触させてしばらく置くと、やがて温度は等しくなる。この状態を熱平衡と呼ぶ。
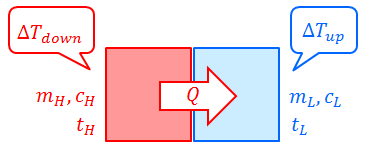
それでは、温度t(H)の高温物体と、温度t(L)の低温物体を接触させて熱平衡の状態になるまで置いたあとの温度tを求めてみよう。
高温物体の温度がΔT(down)だけ下がったとすると、この物体が失った熱量Q(out)は、熱量の公式を使って、
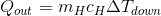
と表すことができる。
続いて、低温物体の温度がΔT(up)だけ上がったとすると、この物体が得た熱量Q(in)は、熱量の公式を使って、
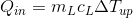
と表すことができる。
いま、高温物体が失った熱量Q(out)がそのまま低温物体へ移ったとすると、

という関係が成り立つことになる。熱は消えたり現れたりすることなく移動しただけという意味で、この関係を熱量の保存という。
また、高温物体の温度はt(H)→tと低下しているから、どれだけ下がったかというと、
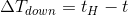
であり、低温物体の温度はt(L)→tと変化しているから、どれだけ上がったかというと、
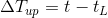
である。
以上より、

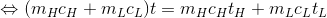
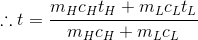
ということが分かる。
